13 de mayo del 2022 / Ensayos Clínicos
Por: Parent Project Muscular Dystrophy
Entrada Therapeutics ha compartido nuevos datos de un estudio preclínico evaluando ENTR-601-44, una terapia de omisión de exón establecida para personas con Duchenne susceptibles de omitir el exón 44.
Nos complace escuchar nuevos datos sobre este potencial terapéutico y saber que la compañía está en camino de presentar una solicitud de nuevo fármaco en investigación (IND, por sus siglas en inglés) a la FDA en el cuarto trimestre del 2022 con la esperanza de iniciar un ensayo clínico en participantes con Duchenne.
Haga clic aquí para saber más.
LEA EL COMUNICADO DE PRENSA DE ENTRADA:Entrada Therapeutics presenta nuevos datos que respaldan su creciente línea de investigación de terapias con Vehículos de Escape Endosomal (EEV™, por sus siglas en inglés) en TIDES USA 2022.
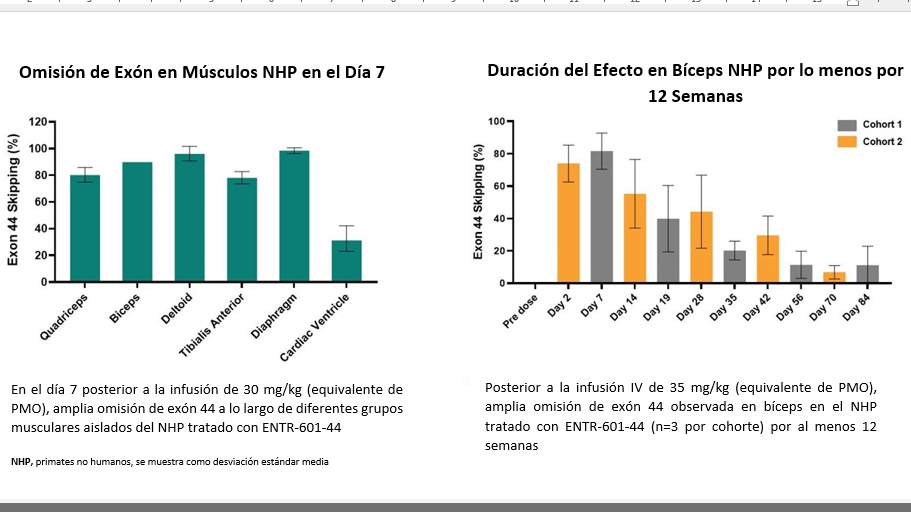
Una sola dosis IV de ENTR-601-44 resultó en una fuerte omisión de exón en los músculos esqueléticos y cardíacos en NHP, así como una duración prolongada del efecto durante al menos 12 semanas.
Nuevos datos de primates no humanos demuestran una durabilidad de la respuesta durante 12 semanas para el candidato clínico principal, ENTR-601-44, para el tratamiento potencial de la distrofia muscular de Duchenne.
El segundo candidato clínico, ENTR-701, fue anunciado para el tratamiento potencial de la distrofia miotónica tipo 1.
Se está en proceso de presentar solicitudes de nuevos fármacos en investigación a la Administración de Alimentos y Medicamentos de EE. UU. para ENTR-601-44 dirigido a la distrofia muscular de Duchenne en el cuarto trimestre del 2022 y para ENTR-701 dirigido a la distrofia miotónica tipo 1 en 2023.
BOSTON, 11 de mayo del 2022 (GLOBE NEWSWIRE) — Entrada Therapeutics, Inc. (Nasdaq: TRDA), una compañía biofarmacéutica que tiene como objetivo transformar la vida de los pacientes mediante el establecimiento de terapias intracelulares de Vehículos de Escape Endosómicos (EEV™, por sus siglas en inglés) como una nueva clase de medicamentos, presentó hoy actualizaciones de sus dos programas principales en TIDES USA 2022: Conferencia de Terapéutica de Oligonucleótidos y Péptidos.
La compañía anunció nuevos datos de primates no humanos (NHP) que demuestran la durabilidad de la respuesta durante 12 semanas para ENTR-601-44, un oligómero de morfolino fosforodiamidato (PMO) conjugado con EEV para el tratamiento potencial de personas con distrofia muscular de Duchenne (DMD) que son susceptibles de omitir el exón 44. Entrada también anunció su segundo candidato clínico, ENTR-701, un EEV-PMO que la compañía está desarrollando como un posible tratamiento alelo-específico para las personas que viven con distrofia miotónica tipo 1 (DM1).
“Nos enorgullece presentar nuevos datos en TIDES USA para nuestro principal candidato clínico, ENTR-601-44 para la distrofia muscular de Duchenne, y anunciar nuestro candidato clínico para la distrofia miotónica tipo 1 a medida que continuamos expandiendo nuestra línea de investigación de terapias EEV”. dijo Natarajan Sethuraman, PhD, director científico de Entrada.
“Hasta la fecha, hemos generado datos preclínicos sólidos in vitro e in vivo que respaldan el avance de nuestros programas DMD y DM1. Estos datos alentadores refuerzan el potencial de nuestros candidatos terapéuticos de EEV para atacar objetivos causantes de enfermedades que antes eran inaccesibles y no tratables dentro de las células, y esperamos presentar datos adicionales en las próximas reuniones científicas”.
Los nuevos datos de un estudio preclínico que evalúa ENTR-601-44 para el tratamiento potencial de la DMD muestran una fuerte omisión del exón 44 en los bíceps NHP durante 12 semanas después de una única infusión intravenosa (IV), lo que demuestra la durabilidad de la respuesta (consulte la Figura 1). Estos datos se basan en un estudio de NHP reportado anteriormente que indica una fuerte omisión del exón 44 en diferentes grupos musculares a los 7 días después de una única infusión IV.Figura 1: Una dosis IV única de ENTR-601-44 resultó en una fuerte omisión de exón en los músculos esqueléticos y cardíacos en NHP, así como una duración prolongada del efecto durante al menos 12 semanas

La selección de ENTR-701 como candidato clínico de Entrada para DM1 se basó en nuevos datos preclínicos que indicaban una corrección prolongada del empalme en el tibial anterior, el tríceps y el cuádriceps, y una mejoría de la miotonía en un modelo de ratón con DM1 después de una dosis única.
La presentación, titulada “Vehículo de escape endosomal (EEV) – La Conjugación Mejora la Entrega Funcional de Oligonucleótidos”, a cargo del Dr. Leo Ziqing Qian, cofundador y vicepresidente de Discovery Research en Entrada, estará disponible en la sección Publicaciones y Conferencias del sitio web de Entrada después de la conferencia.
Acerca de la distrofia muscular de Duchenne (DMD)
La distrofia muscular de Duchenne es una enfermedad genética rara que causa degeneración muscular progresiva y debilidad en todo el cuerpo. La DMD es causada por mutaciones en el gen DMD, lo que conduce a una producción inadecuada de distrofina, una proteína esencial para mantener la integridad estructural y la función de las células musculares. La DMD provoca una pérdida progresiva de la función muscular en todo el cuerpo, lo que limita la movilidad y provoca complicaciones cardíacas y respiratorias en las últimas etapas de la enfermedad. Las terapias actualmente aprobadas para la DMD buscan mejorar la producción de distrofina, pero hasta la fecha no se han confirmado los beneficios clínicos de estos productos.
Acerca de ENTR-601-44
ENTR-601-44, un oligómero de morfolino fosforodiamidato conjugado con vehículo de escape endosómico (EEV™) patentado, es el primer candidato clínico novedoso de la creciente línea de investigación de productos terapéuticos de EEV de Entrada. ENTR-601-44 está diseñado para abordar la causa subyacente de la distrofia muscular de Duchenne al omitir los exones mutados o faltantes en el pre-ARNm inherente a la DMD. ENTR-601-44 tiene el potencial de restaurar el marco de lectura del ARNm y permitir la traducción de la proteína distrofina que está ligeramente acortada pero aún funcional. Entrada espera presentar una solicitud IND ante la FDA de EE. UU. en el cuarto trimestre del 2022, para ENTR-601-44, para el tratamiento potencial de pacientes con distrofia muscular de Duchenne que pueden omitir el exón 44.
Para leer la nota original de divulgación en inglés consulte: https://www.parentprojectmd.org/entrada-therapeutics-shares-new-data-on-entr-601-44-exon-skipping-therapy/
Si desea saber más información acerca de esta artículo de divulgación, contáctese directamente con la fuente original de esta nota.
